Perkembangan Teori Atom - Anda telah mengetahui beberapa unsur dalam kehidupan sehari-hari. Unsur dapat mengalami perubahan materi yaitu perubahan kimia. Ternyata perubahan kimia ini disebabkan oleh partikel terkecil dari unsur tersebut. Partikel terkecil inilah yang kemudian dikenal sebagai atom.
Jika Anda memotong satu batang kapur menjadi dua bagian, kemudian dipotong lagi menjadi dua bagian dan seterusnya maka bagian terkecil yang tidak dapat dibagi lagi inilah yang mengawali berkembangnya konsep atom.
Perkembangan Teori Atom
Konsep atom itu dikemukakan oleh Demokritos yang tidak didukung oleh eksperimen yang meyakinkan, sehingga tidak dapat diterima oleh beberapa ahli ilmu pengetahuan dan filsafat.
Perkembangan teori atom-atom secara ilmiah dimulai oleh John Dalton (1805), kemudian dilanjutkan oleh Thomson (1897), Rutherford (1911), Bohr (1914) dan Schrodinger (1926).
Hasil eksperimen yang memperkuat konsep atom ini menghasilkan gambaran mengenai susunan partikel-partikel tersebut di dalam atom. Gambaran ini berfungsi untuk memudahkan dalam memahami sifat-sifat kimia suatu atom. Gambaran susunan partikel-partikel dasar dalam atom disebut model atom.
Teori Atom Dalton
John Dalton (1766-1844) ialah seorang guru SMU di Manchester, Inggris. Ia terkenal karena teorinya yang membangkitkan kembali istilah "atom". Dalam buku karangannya yang berjudul New System of Chemical Philosophy ia berhasil merumuskan hal tentang atom sekitar tahun 1803.
 |
| John Dalton |
Ia menyatakan bahwa materi terdiri atas atom yang tidak dapat dibagi lagi. Tiap-tiap unsur terdiri atas atomatom dengan sifat dan massa identik, dan senyawa terbentuk jika atom dari berbagai unsur bergabung dalam komposisi yang tetap. Temuannya didasarkan pada sebuah eksperimen. John Dalton menggambarkan atom seperti bola pejal.
 |
| Model Atom Dalton |
Berikut 5 Teori Atom Dalton:
- Unsur-unsur terdiri dari partikel-partikel yang luar biasa kecil yang tidak dapat dibagi kembali (disebut atom). Dalam reaksi kimia, mereka tidak dapat diciptakan, dihancurkan atau diubah menjadi jenis unsur yang lain.
- Semua atom dalam unsur yang sejenis adalah sama dan oleh karena itu memiliki sifat-sifat yang serupa;seperti massa dan ukuran.
- Atom dari unsur-unsur yang berbeda jenis memiliki sifat-sifat yang berbeda pula.
- Senyawa dapat dibentuk ketika lebih dari 1 jenis unsur yang digabungkan.
- Atom-atom dari 2 unsur atau lebih dapat direaksikan dalam perbandinganperbandingan yang berbeda untuk menghasilkan lebih dari 1 jenis senyawa
Kelebihan Teori Atom Dalton
- Memungkinkan kita untuk menjelaskan hukum kombinasi kimia.
- Dalton adalah orang pertama yang mengakui perbedaan yang bisa diterapkan antara partikel dari suatu unsur (atom) dan dari senyawa (molekul).
Kelemahan Teori Atom Dalton
- Ketidakterpisahan atom terbukti salah, karena, atom dapat dibagi lagi menjadi proton, neutron dan elektron. Namun atom adalah partikel terkecil, yang sangat berpengaruh dalam reaksi kimia.
- Menurut Dalton, atom-atom dari unsur yang sama adalah sama dalam segala hal. Pernyataan ini salah karena atom dari beberapa unsur berbeda dalam hal massa dan kepadatan. Atom seperti dari unsur yang sama memiliki massa yang berbeda disebut isotop. Misalnya, klorin memiliki dua isotop yang memiliki nomor massa 35 dan 37 satuan massa atom (sma).
- Dalton juga mengatakan atom elemen yang berbeda berbeda dalam segala hal. Hal ini telah terbukti salah dalam kasus-kasus tertentu seperti atom argon dan atom kalsium, yang memiliki massa atom yang sama yaitu 40. Atom unsur berbeda yang memiliki massa atom yang sama disebut isobar.
- Menurut Dalton atom unsur yang berbeda bergabung dalam rasio nomor sederhana keseluruhan untuk membentuk senyawa. Hal ini tidak terlihat pada senyawa organik kompleks seperti gula C12H22O11
- Teori ini gagal untuk menjelaskan keberadaan alotrop. Perbedaan sifat arang, grafit, berlian tidak dapat dijelaskan karena ketiganya terdiri dari atom yang sama yaitu karbon.
Meskipun teorinya memiliki banyak kekurangan namun ia tetap dianggap sebagai bapak pencetus teori atom modern, terlebih lagi karena teorinya tersebut mampu menerangkan Hukum kekekalan massa Lavoisier dan Hukum perbandingan tetap Proust. [ Karakteristik Benda dalam Kehidupan Sehari-hari ]
Teori Atom J.J. Thomson
Kelemahan dari Dalton diperbaiki oleh JJ. Thomson, eksperimen yang dilakukannya tabung sinar kotoda. Hasil eksperimennya menyatakan ada partikel bermuatan negatif dalam atom yang disebut elektron. Suatu bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif sehingga atom bersifat netral.
 |
| JJ. Thomson |
Teori Atom Thomson adalah salah satu teori yang mencoba mendeskripsikan bentuk atom yaitu seperti bentuk roti kismis. Diibaratkan sebagai roti kismis karena saat itu Thomson beranggapan bahwa atom bermuatan positif dengan adanya elektron bermuatan negatif di sekelilingnya. Perhatikan gambar berikut.
 |
| Model Atom JJ. Thomson |
Pada gambar di atas, bagian berwarna oranye bermuatan positif, sedangkan berwarna hijau adalah elektron yang bermuatan negatif.
Sampai akhir abad ke-19, konsep mengenai bentuk atom masih berupa bola pejal layaknya bola biliar.
Sedangkan pada tahun 1987 Joseph John Thomson secara total merubah konsep atom dengan adanya penemuan elektron yang dikenal dengan teori atom Thomson.
Sekiranya teori atom Thomson dapat diringkas sebagai berikut :
- Atom berupa bola yang bermuatan positif dengan adanya elektron yang bermuatan negatif di sekelilingnya.
- Muatan positif dan negatif pada atom besarnya sama. Hal ini menjadikan atom bermuatan netral. Suatu atom tidak mempunyai muatan positif atau negatif yang berlebihan.
Kelebihan Atom Thompson
Teori Thomson ini mempunyai kelebihan yakni bisa mampu membuktikan adanya partikel lain yang memiliki muatan negatif dalam atom. Berarti atom tersebut bukan merupakan bagian yang terkecil dari suatu unsur namun teori ini juga tidak dapat menjelaskan bahwa susunan muatan positif serta juga negatif dalam bola atom tersebut.
Kelemahan Atom Thompson
- Tidak bisa menentukan gerakan elektron di dalam atom
- Tidak dapat menentukan massa elektron.
Teori Thomson memiliki kelebihan yaitu mampu membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur namun teori ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
Selain roti kismis, teori atom Thomson dapat diumpamakan sebagai semangka. Daging buah yang berwarna merah melambangkan ruang yang bermuatan positif, sedangkan biji yang tersebar di dalamnya adalah elekton yang bermuatan negatif.
Penemuan Elektron
Elektron ditemukan oleh J.J. Thomson melalui percobaan tabung sinar katoda. Pada saat itu, Thomson melihat bahwa jika arus listrik melewati tabung vakum, ada semacam aliran berkilau yang terbentuk. Thomson menemukan bahwa aliran berkilau tersebut dibelokkan ke arah plat kutub positif. Teori atom Thomson membuktikan bahwa aliran tersebut terbentuk dari partikel kecil dari atom dan partikel terebut bermuatan negatif. Thomson menamai penemuan tersebut sebagai elektron.
Teori Atom Rutherford
Pada tahun 1909 Hans Geiger dan Ernest Marsden dengan petunjuk dari Ernest Rutherford melakukan eksperimen di Laboratorium Fisika Universitas Manchester untuk membuktikan kebenaran dari teori atom yang dikemukakan oleh Thomson.
 |
| Ernest Rutherford |
Eksperimen ini melibatkan penambakan partikel alfa (inti atom helium atau ion helium dengan muatan positip) yang diemisikan oleh unsur Radium pada lempengan logam emas tipis dan kemudian mendeteksi partikel alfa yang telah melewati lempengan logam emas tersebut dengan menggunakan layar yang dilapisi seng sulfida (ZnS) sebagai dtetektor. [ Prinsip Pembentukan Molekul ]
 |
| Model Eksperimen Ernest Rutherford |
Rutherford berpendapat bahwa apabila struktur atom yang dikemukakan oleh Thomson adalah benar maka sebagian besar berkas partikel alfa akan melewati lempengan logam emas dan sebagian kecil sekali yang akan didefleksi.
Akan tetapi hasil eksperimen Rutherford sangat mengejutkan, walaupun sebagian besar berkas partikel alfa melewati lempengan logam emas, terdapat banyak berkas partikel alfa yang didefleksi dengan sudut yang besar (lebih dari 900), bahkan terdapat berkas partikel alfa yang direfleksi kembali kearah sumber tanpa pernah menyentuh layer detector (perhatikan gambar).
 |
| Hasil Eksperimen Ernest Rutherford |
Setelah merunut pola-pola partikel alfa yang ditembakkan ke lempeng logam emas, maka Rutherford mengambil kesimpulan bahwa sebagian besar ruang dalam atom adalah “ruang kosong”, dan terdapat massa yang terkonsentrasi pada pusat atom yang bermuatan positif dimana ukurannya 10.000 kali lebih kecil dibanding ukuran keseluruhan bagian atom, dan elektron mengelilingi inti atom tersebut seperti planet-planet kita mengelilingi matahari.
Rutherford menyimpulkan struktur atom tersebut berlandaskan eksperimennya sebagai berikut:
- Sebagian besar berkas partikel alfa yang dapat melewati lempengan logam emas menunjukan bahwa partikel alfa ini melewati ruang kosong yang ada di dalam atom sehingga dengan mudah partikel alfa ini melewati ruang kosong tersebut tanpa hambatan yang berarti.
- Berkas partikel alfa yang didefleksi menunjukan bahwa partikel alfa tersebut berada pada posisi yang dekat dengan inti atom yang bermuatan positif. Muatan positif dengan muatan positif akan saling tolak menolak, hal inilah yang menyebabkan partikel alfa dibelokan dengan sudut yang besar.
- Berkas partikel alfa yang di refleksi kembali (dipantulkan kembali) menunjukan bahwa partikel alfa tersebut bertumbukkan dengan inti atom yang bermuatan positif. Inti atom emas mempunyai massa dan muatan positif yang lebih besar disbanding dengan massa dan muatan partikel alfa, hal inilah yang membuat partikel alfa di pantulkan kembali.
 |
| Model Atom Rutherford |
Berdasarkan hal tersebut diatas maka Rutherford mengajukan model atom seperti gambar berikut.
Kelebihan Atom Rutherford
- Bahwa atom memiliki inti atom yang bermuatan positif dan disekelilingnya terdapat elektron yang mengelilinya.
- Dapat menerangkan fenomena penghamburan partikel alfa oleh selaput tipis emas
- Jari-jari inti atom dan jari-jari atom sudah dapat ditemukan
- Sudah dapat menerangkan / menentukan bentuk lintasan elektron yang mengelilingi inti atom
- Dapat menggambarkan gerak elektron disekitar inti
- Elektron dapat bergerak dalam lintasan apapun, dari lintasan yang tak terhingga jumlahnya
Kekurangan Atom Rutherford
- Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap ini atom.
- Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
- Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
- Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom.
Berdasarkan teori fisika, gerakan elektron mengelilingi inti ini disertai pemancaran energi sehingga lama-kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti.
Teori Atom Niels Bohr
Model atom Bohr mengemukakan bahwa atom terdiri dari inti berukuran sangat kecil dan bermuatan positif dikelilingi oleh elektron bermuatan negatif yang mempunyai orbit. Inilah gambar teori model atom Bohr. Penjelasan teori atom Bohr dapat dibaca pada sub bunyi postulat teori atom Bohr di bawah.
 |
| Niels Bohr |
Niels Bohr mengajukan teori atom Bohr ini pada tahun 1915. Karena model atom Bohr merupakan modifikasi (pengembangan) dari model atom Rutherford, beberapa ahli kimia menyebutnya dengan teori atom Rutherford-Bohr. [ Atom dan Partikel Penyusunnya ]
Model atom Bohr berbentuk seperti tata surya, dengan elektron yang berada di lintasan peredaran (orbit) mengelilingi inti bermuatan positif yang ukurannya sangat kecil. Gaya gravitasi pada tata surya secara matematis dapat diilustrasikan sebagai gaya Coulomb antara nukleus (inti) yang bermuatan positif dengan elektron bermuatan negatif.
Bunyi Postulat Teori Atom Bohr
Teori atom Bohr kiranya dapat dijelaskan seperti berikut:
- Elektron mengitari inti atom dalam orbit-orbit tertentu yang berbentuk lingkaran. Orbit-orbit ini sering disebut sebagai kulit-kulit elektron yang dinyatakan dengan notasi K, L, M, N ... dst yang secara berututan sesuai dengan n = 1, 2, 3, 4 ... dst.
- Elektron dalam tiap orbit mempunyai energi tertentu yang makin tinggi dengan makin besarnya lingkaran orbit atau makin besarnya harga n. Energi ini bersifat terkuantisasi dan harga-harga yang diijinkan dinyatakan oleh harga momentum sudut elektron yang terkuantisasi sebesar n (h/2π) dengan n = 1, 2, 3, 4 ... dst.
- Selama dalam orbitnya, elektron tidak memancarkan energi dan dikatakan dalam keadaan stasioner. Keberadaan elektron dalam orbit stasioner ini dipertahankan oleh gaya tarik elektrostatik elektron oleh inti atom yang diseimbangkan oleh gaya sentrifugal dari gerak elektron.
- Elektron dapat berpindah dari orbit satu ke orbit lain yang mempunyai energi lebih tinggi bila elektron tersebut menyerap energi yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan, dan sebaliknya bila elektron berpindah ke orbit yang mempunyai energi lebih rendah akan memancarkan energi radiasi yang teramati sebagai spektrum garis yang besarnya sesuai dengan perbedaan energi antara kedua orbit yang bersangkutan.
- Atom dalam molekul dikatakan dalam keadaan tingkat dasar (ground state) apabila elektron-elektronnya menempati orbit-orbit sedemikian sehingga memberikan energi total terendah. Dan apabila elektron-elektron menempati orbit-orbit yang memberikan energi lebih tinggi daripada energi tingkat dasarnya dikatakan atom dalam tingkat tereksitasi (excited state). Atom dalam keadaan dasar lebih stabil daripada dalam keadaan tereksitasi.
Model Hidrogen Bohr
Contoh paling sederhana dari model atom hidrogen Bohr (Z = 1) atau sebuah ion mirip hidrogen (Z > 1), yang mempunyai elektron bermuatan negatif mengelilingi inti bermuatan positif. Energi elektromagnetik akan diserap atau dilepaskan ketika sebuah elektron berpindah dari lintasan satu ke lintasan lain. Jarijari dari lintasan bertambah sebagai n2, dimana n adalah bilangan kuantum utama.
Transisi dari 3 ke 2 menghasilkan garis pertama dalam deret Balmer. Untuk hidrogen (Z = 1) akan menghasilkan foton dengan panjang gelombang 656 nm (cahaya merah).
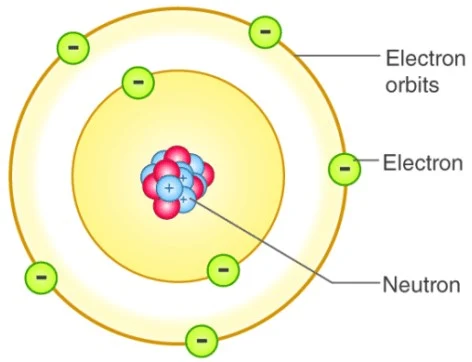 |
| Model Atom Niels Bohr |
Kelebihan model atom Bohr
- Atom terdiri dari beberapa kulit/subkulit untuk tempat berpindahnya electron dan atom membentuk suatu orbit dimana inti atom merupakan positif dan disekelilingnya terdapat elektron.
- Teori atom Bohr dapat menjelaskan tetapan Rydberg untuk garis spektra emisi hidrogen
Kelemahan Teori Atom Bohr
Walaupun dinilai sudah revolusioner, tetapi masih ditemukan kelemahan teori atom Bohr yaitu:
- Melanggar asas ketidakpastian Heisenberg karena elektron mempunyai jari-jari dan lintasan yang telah diketahui.
- Model atom Bohr mempunyai nilai momentum sudut lintasan ground state yang salah.
- Lemahnya penjelasan tentang prediksi spektra atom yang lebih besar.
- Tidak dapat memprediksi intensitas relatif garis spektra.
- Model atom Bohr tidak dapat menjelaskan struktur garis spektra yang baik.
- Tidak dapat menjelaskan efek Zeeman.
Teori Atom Mekanika Kuantum (Atom Modern)
Teori mekanika kuantum diperkenalkan oleh fisikawan asal Austria Erwin Schrodinger (yang juga terkenal dengan eksperimen pikiran terkenal “Kucing Schrodinger”) dan fisikawan asal Jerman Werner Heisenberg. Mereka berpendapat bahwa posisi elektron tidak hanya ada di lintasan-lintasan sehingga tidak bisa ditentukan posisinya secara pasti. Namun posisi elektron dapat diprediksi melalui peluang keberadaan elektron. Daerah yang memiliki peluang yang besar disebut dengan orbital. [ Molekul dalam Benda Mati dan Makhluk Hidup ]
 |
| Erwin Schrodinger |
Schrodinger dan Heisenberg kemudian mengajukan model atom yang sampai saat ini masih digunakan. Dalam model ini, atom terdiri dari inti atom yang bermuatan positif dan dikelilingi oleh elektron-elektron yang berada pada orbital-orbital.
.jpg) |
| Model Atom Mekanika Kuantum (Atom Modern) |
Model atom mekanika kuantum merupakan model atom modern yang berkembang dan melengkapi kekurangan dari model atom bohr. model atom modern didasarkan pada tiga hal berikut:
- menurut “Louis de Broglie”, elektron bersifat gelombang dan partikel.
- menurut “Werner Heisenberg”, dengan asas ketidakpastian bahwa ruang disekitar inti ditemukan elektron yang disebut orbital.
- menurut “Erwin Schrodinger”, mengenai persamaan gelombang elektron dalam atom.
Dari ketiga hal diatas, maka diperoleh model atom modern sebagai berikut:
- elektron-elektron mengitari inti atom dan berada pada orbital-orbital tertentu yang membentuk kulit atom.
- orbital merupakan ruang disekitar inti dimana elektron dapat ditemukan.
- kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan kuantum.
Menurut teori atom mekanika kuantum, posisi elektron dalam mengelilingi inti atom tidak dapat diketahui secara pasti sesuai prinsip ketidakpastian Heisenberg. Oleh karena itu, kebolehjadian (peluang) terbesar ditemukannya elektron berada pada orbit atom tersebut. Dengan kata lain, orbital adalah daerah kebolehjadian terbesar ditemukannya elektron dalam atom.
Menurut model atom mekanika kuantum, gerakan elektron dalam mengelilingi inti atom memiliki sifat dualisme sebagaimana diajukan oleh de Broglie. Oleh karena gerakan elektron dalam mengelilingi inti memiliki sifat seperti gelombang maka persamaan gerak elektron dalam mengelilingi inti harus terkait dengan fungsi gelombang. Dengan kata lain, energi gerak (kinetik) elektron harus diungkapkan dalam bentuk persamaan fungsi gelombang.
Persamaan yang menyatakan gerakan elektron dalam mengelilingi inti atom dihubungkan dengan sifat dualisme materi yang diungkapkan dalam bentuk koordinat Cartesius. Persamaan ini dikenal sebagai persamaan Schrodinger.
Dari persamaan Schrodinger ini dihasilkan tiga bilangan kuantum, yaitu bilangan kuantum utama (n), bilangan kuantum azimut( A ), dan bilangan kuantum magnetik(m). Ketiga bilangan kuantum ini merupakan bilangan bulat sederhana yang menunjukkan peluang adanya elektron di sekeliling inti atom. Penyelesaian persamaan Schrodinger menghasilkan tiga bilangan kuantum. Orbital diturunkan dari persamaan Schrodinger sehingga terdapat hubungan antara orbital dan ketiga bilangan kuantum tersebut.

